29 दिसंबर की सुबह, NEJM ने नए चीनी कोरोनावायरस VV116 पर एक नया नैदानिक चरण III अध्ययन ऑनलाइन प्रकाशित किया। परिणामों से पता चला कि नैदानिक सुधार की अवधि के मामले में VV116, पैक्सलोविड (नेमाटोविर/रिटोनाविर) से ज़्यादा खराब नहीं था और इसके प्रतिकूल प्रभाव भी कम थे।
छवि स्रोत:NEJM
औसत रिकवरी समय 4 दिन, प्रतिकूल घटना दर 67.4%
वीवी116 एक मौखिक न्यूक्लियोसाइड एंटी-न्यू कोरोना वायरस (SARS-CoV-2) दवा है जिसे जुन्सिट और वांग शान वांग शुई के सहयोग से विकसित किया गया है, और यह गिलियड के रेमेडिसविर, मर्क शार्प एंड डोहम के मोलनुपिराविर और रियल बायोलॉजिक्स के एज़ेलवुडिन के साथ मिलकर एक आरडीआरपी अवरोधक है।
2021 में, उज़्बेकिस्तान में VV116 का चरण II नैदानिक परीक्षण पूरा हुआ। अध्ययन के परिणामों से पता चला कि VV116 समूह नैदानिक लक्षणों में बेहतर सुधार कर सकता है और नियंत्रण समूह की तुलना में गंभीर रूप और मृत्यु की ओर बढ़ने के जोखिम को काफी कम कर सकता है। इस परीक्षण के सकारात्मक परिणामों के आधार पर, VV116 को उज़्बेकिस्तान में मध्यम से गंभीर COVID-19 रोगियों के उपचार के लिए अनुमोदित किया गया है, और यह चीन में विदेशों में विपणन के लिए अनुमोदित पहली नई मौखिक कोरोनरी दवा बन गई है [1]।
शंघाई रुइजिन अस्पताल के प्रो. झाओ रेन, शंघाई रेन्जी अस्पताल के प्रो. गाओयुआन और शंघाई रुइजिन अस्पताल के शिक्षाविद निंग गुआंग के नेतृत्व में यह चरण III नैदानिक परीक्षण[2] (एनसीटी05341609) मार्च से मई तक शंघाई में ओमिक्रॉन वेरिएंट (बी.1.1.529) के कारण हुए प्रकोप के दौरान पूरा किया गया था, जिसका उद्देश्य हल्के से मध्यम कोविड-19 के रोगियों के शुरुआती उपचार के लिए पैक्सलोविड बनाम वीवी116 की प्रभावकारिता और सुरक्षा का मूल्यांकन करना था। इसका उद्देश्य हल्के से मध्यम कोविड-19 के रोगियों के शुरुआती उपचार के लिए पैक्सलोविड बनाम वीवी116 की प्रभावकारिता और सुरक्षा का मूल्यांकन करना था।
छवि स्रोत: संदर्भ 2
चीन के शंघाई के सात अस्पतालों के प्रतिभागियों की पात्रता का आकलन करने के लिए 4 अप्रैल से 2 मई 2022 के बीच, प्रगति के उच्च जोखिम वाले और हल्के से मध्यम लक्षणों वाले 822 वयस्क कोविड-19 रोगियों का एक बहुकेंद्रीय, पर्यवेक्षक-अंधा, यादृच्छिक, नियंत्रित परीक्षण किया गया। अंततः, 771 प्रतिभागियों को मौखिक दवा के रूप में या तो VV116 (पहले दिन हर 12 घंटे में 384, 600 मिलीग्राम और दूसरे-पाँचवें दिन हर 12 घंटे में 300 मिलीग्राम) या पैक्सोविड (5 दिनों के लिए हर 12 घंटे में 387, 300 मिलीग्राम निमातुवीर + 100 मिलीग्राम रिटोनावीर) दिया गया।
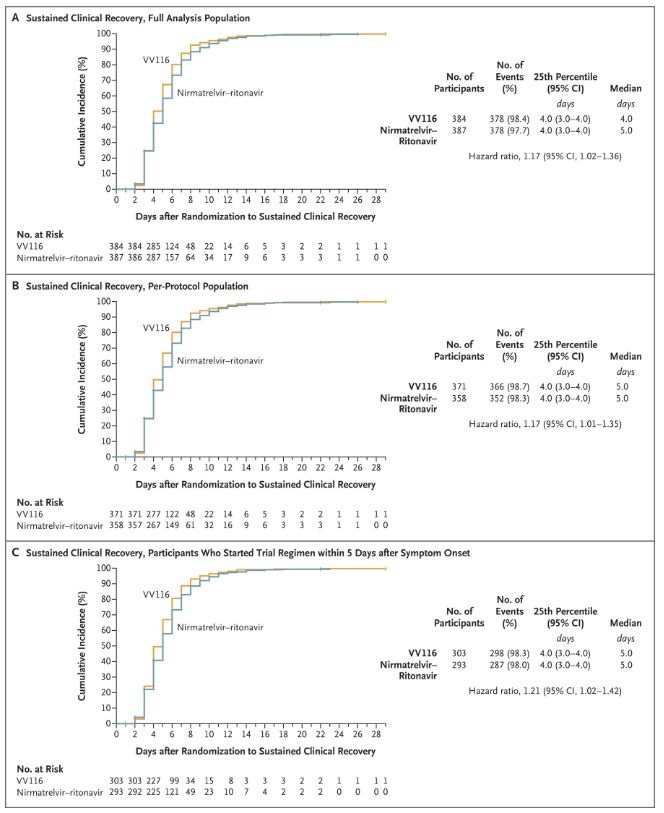
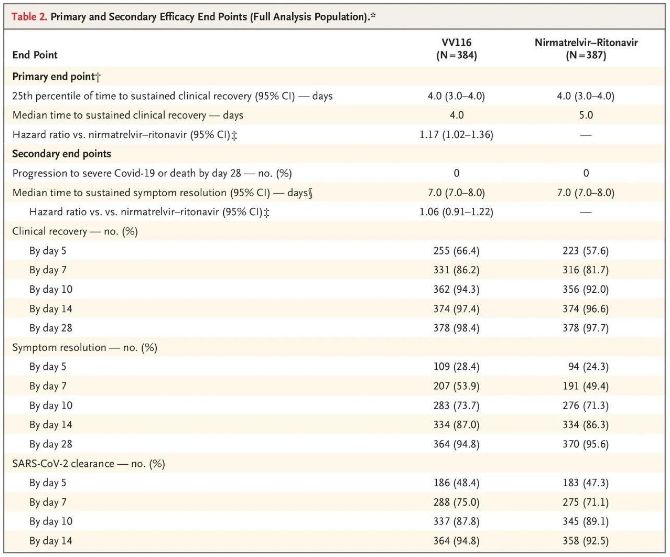
इस नैदानिक अध्ययन के परिणामों से पता चला है कि हल्के से मध्यम COVID-19 के लिए VV116 के साथ प्रारंभिक उपचार ने नैदानिक प्रोटोकॉल द्वारा अनुमानित प्राथमिक समापन बिंदु (निरंतर नैदानिक रिकवरी का समय) को पूरा किया: नैदानिक रिकवरी का औसत समय VV116 समूह में 4 दिन और पैक्सलोविड समूह में 5 दिन था (खतरा अनुपात, 1.17; 95% CI, 1.02 से 1.36; निचली सीमा। >0.8)।
नैदानिक पुनर्प्राप्ति समय बनाए रखना
प्राथमिक और द्वितीयक प्रभावकारिता समापन बिंदु (जनसंख्या का व्यापक विश्लेषण)
छवि स्रोत: संदर्भ 2
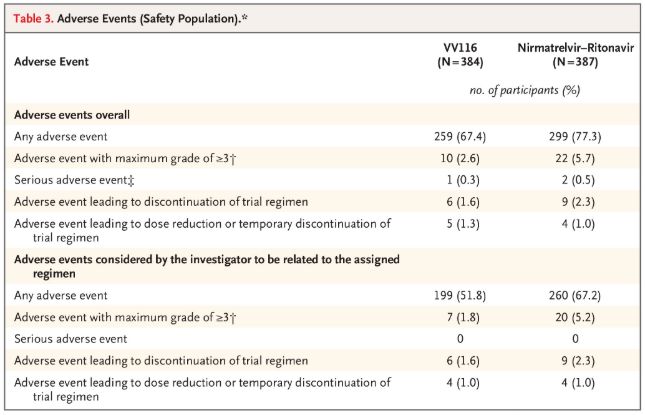
सुरक्षा के संदर्भ में, 28-दिवसीय अनुवर्ती में VV116 प्राप्त करने वाले प्रतिभागियों ने पैक्सलोविड (77.3%) प्राप्त करने वालों की तुलना में कम प्रतिकूल घटनाओं (67.4%) की सूचना दी, और ग्रेड 3/4 प्रतिकूल घटनाओं की घटना पैक्सलोविड (5.7%) की तुलना में VV116 (2.6%) के लिए कम थी।
प्रतिकूल घटनाएँ (सुरक्षित लोग)
छवि स्रोत: संदर्भ 2
विवाद और प्रश्न
23 मई, 2022 को, जुनिपर ने खुलासा किया कि हल्के से मध्यम COVID-19 (NCT05341609) के प्रारंभिक उपचार के लिए VV116 बनाम PAXLOVID के चरण III पंजीकरण नैदानिक अध्ययन ने अपने प्राथमिक अध्ययन समापन बिंदु को पूरा किया।
छवि स्रोत: संदर्भ 1
ऐसे समय में जब परीक्षण के विवरण का अभाव था, चरण III अध्ययन के आसपास विवाद दोहरा था: पहला, यह एकल-अंधा अध्ययन था और प्लेसीबो नियंत्रण की अनुपस्थिति में, यह आशंका थी कि दवा का पूरी तरह से निष्पक्ष मूल्यांकन करना कठिन होगा; दूसरा, नैदानिक समापन बिंदुओं के बारे में प्रश्न थे।
जुनिपर के लिए नैदानिक समावेशन मानदंड हैं: (i) नए क्राउन परीक्षण के सकारात्मक परिणाम, (ii) एक या एक से अधिक हल्के या मध्यम COVID-19 लक्षण, और (iii) गंभीर COVID-19 के उच्च जोखिम वाले रोगी, जिनमें मृत्यु भी शामिल है। हालाँकि, एकमात्र प्राथमिक नैदानिक समापन बिंदु 'निरंतर नैदानिक सुधार का समय' है।
घोषणा से ठीक पहले, 14 मई को, जुनिपर ने नैदानिक प्राथमिक समापन बिंदुओं में से एक, “गंभीर बीमारी या मृत्यु में रूपांतरण का अनुपात” [3] को हटाकर नैदानिक समापन बिंदुओं को संशोधित किया था।
छवि स्रोत: संदर्भ 1
प्रकाशित अध्ययन में विवाद के इन दो मुख्य बिंदुओं पर भी विशेष रूप से ध्यान दिया गया था।
ओमिक्रॉन के अचानक प्रकोप के कारण, पैक्सलोविड के लिए प्लेसीबो टैबलेट का उत्पादन परीक्षण शुरू होने से पहले पूरा नहीं हो पाया था और इसलिए जाँचकर्ता डबल-ब्लाइंड, डबल-मॉक डिज़ाइन का उपयोग करके यह परीक्षण करने में असमर्थ थे। नैदानिक परीक्षण के सिंगल-ब्लाइंड पहलू के बारे में, जुनिपर ने कहा कि प्रोटोकॉल नियामक अधिकारियों के साथ संवाद के बाद आयोजित किया गया था और सिंगल-ब्लाइंड डिज़ाइन का अर्थ है कि न तो जाँचकर्ता (अध्ययन समापन बिंदु के मूल्यांकनकर्ता सहित) और न ही प्रायोजक को विशिष्ट चिकित्सीय दवा आवंटन का पता तब तक चलेगा जब तक कि अध्ययन के अंत में अंतिम डेटाबेस लॉक न हो जाए।
अंतिम विश्लेषण के समय तक, परीक्षण में भाग लेने वाले किसी भी व्यक्ति ने मृत्यु या गंभीर कोविड-19 घटना की प्रगति का अनुभव नहीं किया था, इसलिए गंभीर या गंभीर कोविड-19 या मृत्यु की प्रगति को रोकने में वीवी116 की प्रभावकारिता के बारे में कोई निष्कर्ष नहीं निकाला जा सकता है। आंकड़ों से संकेत मिलता है कि कोविड-19 से संबंधित लक्षित लक्षणों के यादृच्छिकीकरण से निरंतर प्रतिगमन तक का अनुमानित औसत समय दोनों समूहों में 7 दिन (95% सीआई, 7 से 8) था (खतरा अनुपात, 1.06; 95% सीआई, 0.91 से 1.22) [2]। यह समझाना मुश्किल नहीं है कि 'गंभीर बीमारी या मृत्यु में रूपांतरण की दर' का प्राथमिक समापन बिंदु, जिसे मूल रूप से परीक्षण के अंत से पहले निर्धारित किया गया था, क्यों हटा दिया गया था।
18 मई 2022 को, जर्नल इमर्जिंग माइक्रोब्स एंड इंफेक्शन्स ने ओमिक्रॉन वेरिएंट [4] से संक्रमित रोगियों में वीवी116 के पहले नैदानिक परीक्षण के परिणाम प्रकाशित किए, जो 136 पुष्ट रोगियों के साथ एक खुला, संभावित कोहोर्ट अध्ययन था।
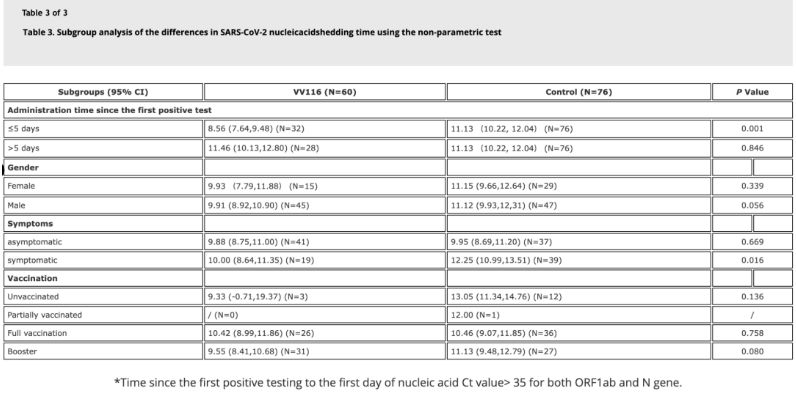
अध्ययन के आंकड़ों से पता चला है कि ओमिक्रॉन संक्रमण से पीड़ित जिन रोगियों ने अपने पहले सकारात्मक न्यूक्लिक एसिड परीक्षण के 5 दिनों के भीतर वीवी116 का उपयोग किया, उनमें न्यूक्लिक एसिड प्रतिगमन का समय 8.56 दिन था, जो नियंत्रण समूह के 11.13 दिनों से कम था। इस अध्ययन की समय-सीमा (पहले सकारात्मक न्यूक्लिक एसिड परीक्षण के 2-10 दिन) के भीतर लक्षण वाले रोगियों को वीवी116 देने से सभी रोगियों में न्यूक्लिक एसिड प्रतिगमन का समय कम हो गया। दवा सुरक्षा की दृष्टि से, वीवी116 उपचार समूह में कोई गंभीर प्रतिकूल प्रभाव नहीं देखा गया।
छवि स्रोत: संदर्भ 4
VV116 पर तीन नैदानिक परीक्षण चल रहे हैं, जिनमें से दो हल्के से मध्यम COVID-19 पर चरण III अध्ययन हैं (NCT05242042, NCT05582629)। मध्यम से गंभीर COVID-19 के लिए दूसरा परीक्षण एक अंतरराष्ट्रीय बहुकेंद्रीय, यादृच्छिक, डबल-ब्लाइंड चरण III नैदानिक अध्ययन (NCT05279235) है, जिसका उद्देश्य मानक उपचार की तुलना में VV116 की प्रभावकारिता और सुरक्षा का मूल्यांकन करना है। जुनिपर की घोषणा के अनुसार, पहले मरीज़ को मार्च 2022 में नामांकित किया गया और उसे खुराक दी गई।
छवि स्रोत: clinicaltrials.gov
संदर्भ:
[1] जुंशी बायोटेक: हल्के से मध्यम COVID-19 के प्रारंभिक उपचार के लिए VV116 बनाम PAXLOVID के चरण III पंजीकृत नैदानिक अध्ययन के मुख्य अंत बिंदु पर घोषणा
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] एन्सी मा, जिंगवेन ऐ, यी झांग, जियानमिंग झेंग, ज़ियाओगांग गाओ, जुनमिंग जू, हाओ यिन, झिरेन फू, हाओ जिंग, ली ली, लियिंग सन, हेयु हुआंग, क्वानबाओ झांग, लिनलिन जू, यान्टिंग जिन, रुई चेन, गुओयू लव, झिजुन झू, वेनहोंग झांग, झेंगक्सिन वांग। (2022) 1881 यकृत प्रत्यारोपण प्राप्तकर्ताओं के बीच ओमिक्रॉन संक्रमण प्रोफ़ाइल और टीकाकरण की स्थिति: एक बहु-केंद्र पूर्वव्यापी समूह। उभरते सूक्ष्मजीव और संक्रमण 11:1, पृष्ठ 2636-2644.
पोस्ट करने का समय: 06 जनवरी 2023
 中文网站
中文网站